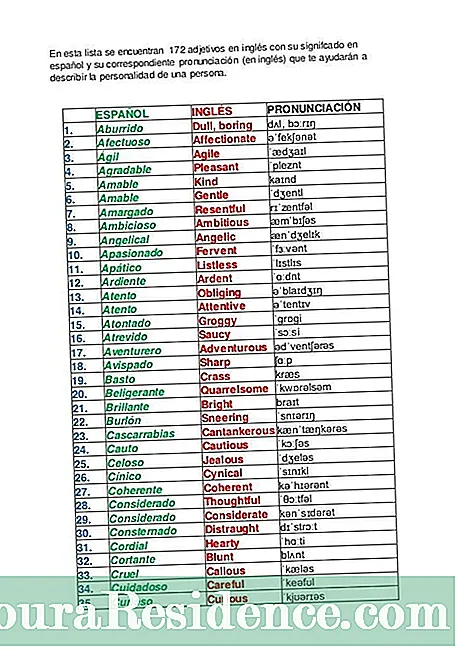
An dá comhdhúile ceimiceacha toisc go bhfuil eilimintí ceimiceacha comhdhéanta de mhóilíní, agus adamh iad seo ar a seal. Fanann na hadaimh aontaithe a bhuíochas le foirmiú an rud mar a thugtar air naisc cheimiceacha.
Tá an níl bannaí ceimiceacha mar an gcéanna: go bunúsach braitheann siad ar shaintréithe leictreonacha na n-adamh atá i gceist. Tá dhá chineál nasc is coitianta ann: bannaí ianacha agus an bannaí comhfhiúsacha.
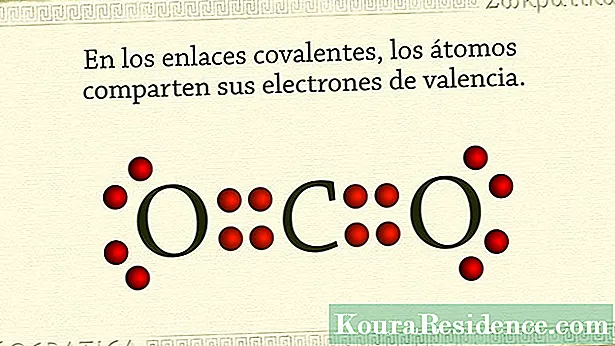
De ghnáth, is iad bannaí comhfhiúsacha na bannaí sin adaimh neamh-mhiotalacha a choinneáil le chéile. Tarlaíonn sé go bhfuil go leor leictreon ag adamh na n-eilimintí seo ina mblaosc is forimeallaí agus go bhfuil claonadh iontu leictreoin a choinneáil nó a fháil, in ionad iad a thabhairt suas.
Sin é an fáth an bealach a ndéanann na substaintí nó na comhdhúile ceimiceacha seoicos cobhsaíocht a bhaint amach is ea trí péire leictreon a roinnt, uní ó gach adamh. Ar an mbealach seo tá an péire leictreon roinnte coitianta don dá adamh agus coinníonn siad le chéile iad ag an am céanna. Sa gáis uaisle, mar shampla, tarlaíonn sé seo. Chomh maith leis sin in eilimintí halaigine.
Nuair a tharlaíonn an banna comhfhiúsach idir eilimintí de leictridhiúltacht chomhchosúil, amhail idir hidrigin agus carbón, gintear banna comhfhiúsach apolar. Tarlaíonn sé seo, mar shampla, i hidreacarbóin.
Mar an gcéanna, cruthaíonn móilíní homonuclear (déanta suas den adamh céanna) i gcónaí bannaí apolar. Ach má tharlaíonn an banna idir eilimintí de leictridhiúltacht éagsúil, táirgtear dlús leictreon níos airde in adamh amháin ná in adamh eile, mar thoradh air seo cruthaítear cuaille.
An tríú féidearthacht ná go roinneann dhá adamh péire leictreon, ach nach gcuireann ach adamh amháin díobh na leictreoin chomhroinnte seo. Sa chás sin labhraímid faoi banna comhfhiúsach dative nó comhordaithe.
Ar feadh nasc dative teastaíonn eilimint uait le péire leictreon saor in aisce (cosúil le nítrigin) agus ceann eile atá easnamhach ó leictreon (cosúil le hidrigin). Is gá freisin go bhfuil an ceann leis an bpéire leictreonach leictreonach go leor gan na leictreoin a chailleadh le roinnt. Tarlaíonn an cás seo, mar shampla, in amóiniam (NH4+).
Tá an substaintí is féidir comhdhúile comhfhiúsacha a bheith ann in aon staid ábhair (soladach, leachtach nó gásach), agus go ginearálta is seoltóirí bochta teasa agus leictreachais iad.
Is minic a thaispeánann siad leáphointí agus fiuchphointe réasúnta íseal Y. de ghnáth bíonn siad intuaslagtha i dtuaslagóirí polacha, cosúil le beinséin nó teitreaclóiríd charbóin, ach tá droch-intuaslagthacht acu in uisce. Tá siad thar a bheith seasmhach.
Is féidir go leor samplaí de chomhdhúile nó de shubstaintí ina bhfuil bannaí comhfhiúsacha a thabhairt:
- Fluairín
- Bróimín
- Iaidín
- Clóirín
- Ocsaigin
- Uisce
- Dé-ocsaíd charbóin
- Amóinia
- Meatán
- Propan
- Silica
- Diamant
- Graifít
- Grianchloch
- Glúcós
- Paraifín
- Díosal
- Nítrigin
- Héiliam
- Freon