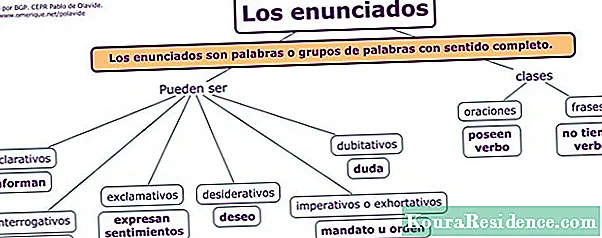
Ábhar
Na substaintí ocsaíditheoirí (O) is substaintí ocsaídiúcháin iad ar féidir leo, faoi dhálaí sonracha teochta agus brú, meascadh le breosla agus a tháirgeadh, go beacht, a dócháin. Sa phróiseas seo laghdaíonn an ocsaíditheoir go breosla agus ocsaídítear an dara ceann acu.
Is gníomhairí ocsaídiúcháin iad ocsaíditheoirí, seans maith go n-imoibríonn laghdú-ocsaídiú an-eisiteirmeach (táirgeann siad teas), meastar go bhfuil an oiread sin substaintí den chineál seo i measc na ndaoine contúirteacha nó a láimhseáil go cúramach, mar go bhféadfadh siad dónna tromchúiseacha a chur faoi deara.
Tugtar oxidizer air freisin, trí shíneadh, aon mheán inar féidir dóchán a dhéanamh.
Féach freisin: Samplaí de Bhreoslaí
Frithghníomhartha "redox"
Tá an ocsaíditheoiríMar oxidants, táirgeann siad imoibrithe "redox", is é sin, laghdú agus ocsaídiú comhuaineach. Sa chineál seo imoibriúcháin, tarlaíonn malartú leictreon sa mhéid go bhfaigheann an ocsaíditheoir leictreoin (laghdaíonn sé) agus go gcaillfidh an laghdaitheoir leictreoin (ocsaídiú). Faigheann na comhpháirteanna uile atá i gceist, ina theannta sin, staid ocsaídiúcháin.
Samplaí den chineál seo imoibriúcháin is ea cásanna pléascadh, sintéis cheimiceach nó creimeadh.
Samplaí d'ocsaídeoirí
- Ocsaigin (O.2). Sármhaitheas par oxidizer, a bhfuil baint aige le beagnach gach imoibriú inadhainte nó pléascach. Déanta na fírinne, ní féidir le gnáth-dhóiteán tarlú mura bhfuil sé as láthair. Go ginearálta, cruthaíonn imoibrithe redox ó ocsaigin, i dteannta le fuinneamh, cainníochtaí CO2 agus uisce.
- Ózón (O.3). Móilín gásach atá neamhchoitianta ó thaobh an chomhshaoil de, cé go bhfuil sé flúirseach i sraitheanna uachtaracha an atmaisféar, is minic a úsáidtear é in íonú uisce agus i bpróisis eile a bhaineann leas as a chumas láidir ocsaídiúcháin.
- Sárocsaíd hidrigine (H.2NÓ2). Ar a dtugtar sárocsaíd hidrigine nó dé-ocsaigin freisin, is leacht an-pholaraithe, an-ocsaídiúcháin é, a úsáidtear go minic chun créachta nó gruaig bleach a dhíghalrú. Tá a fhoirmle éagobhsaí agus bíonn claonadh ann briseadh síos i móilíní uisce agus ocsaigine, ag scaoileadh fuinneamh teasa sa phróiseas. Níl sé inadhainte, ach féadann sé dóchán spontáineach a ghiniúint nuair a bhíonn copar, airgead, cré-umha nó ábhar orgánach áirithe i láthair.
- Hypochlorites (ClO-). Tá na hiain seo le fáil i go leor comhdhúile cosúil le bleachtairí leachtacha (fochlóirít sóidiam) nó púdraithe (fochlóirít chailciam), atá an-éagobhsaí agus a mbíonn claonadh iontu dianscaoileadh i láthair solas na gréine, teasa agus próisis eile. Imoibríonn siad go han-eisiteirmeach le hábhar orgánach, agus iad in ann dóchán a chur faoi deara, agus le mangainéis, ag cruthú sármhanganáiteanna.
- Permanganates. Is salainn iad seo a fhaightear ó aigéad permanganésic (HMnO4), óna bhfaigheann siad an anion MnO4– agus dá bhrí sin mangainéis sa staid ocsaídiúcháin is airde. Is gnách go mbíonn dath violet cumhachtach acu agus inadhainteacht an-ard i dteagmháil le hábhar orgánach., lasair violet a ghiniúint agus féadann sé dónna tromchúiseacha a chruthú.
- Aigéad sárocsaídulfuric (H.2SW5). Tá feidhmeanna tionsclaíocha iontacha ag an solad gan dath seo, atá leáite ag 45 ° C, mar dhífhabhtán agus níos glaine, agus i nginiúint salainn aigéadacha i láthair eilimintí mar photaisiam (K). I láthair móilíní orgánacha, mar éitir agus cetóin, cruthaíonn sé móilíní an-éagobhsaí trí sárocsaídiú, mar shampla sárocsaíd aicéatón.
- Sárocsaíd aicéatón (C.9H.18NÓ6). Ar a dtugtar sárocsaíd, tá an comhdhúil orgánach seo an-phléascach toisc go n-imoibríonn sé go héasca le teas, frithchuimilt nó tionchar. Ar an gcúis seo, d’úsáid go leor sceimhlitheoirí é mar mhaidhmitheoir ina n-ionsaithe agus níor gortaíodh cúpla ceimiceoir agus iad á láimhseáil. Is móilín an-éagobhsaí é, a scaoileann méideanna ollmhóra fuinnimh (pléascadh eantrópach) nuair a dhíscaoileann sé i substaintí eile atá níos cobhsaí.
- Halogens. Is iondúil go gcruthaíonn roinnt eilimintí de ghrúpa VII den tábla peiriadach, ar a dtugtar halaiginí, iain mononegacha mar gheall ar a ngá le leictreoin a leibhéal fuinnimh deireanach a chríochnú, dá bhrí sin salainn a fhoirmiú ar a dtugtar hailídí atá an-ocsaídiúcháin.
- Imoibrí Tollens. Ainmnithe ag an gceimiceoir Gearmánach Bernhard Tollens, is coimpléasc uiscí diamine é (dhá ghrúpa aimíní: NH3) agus airgead, a úsáidtear go turgnamhach chun aildéid a bhrath, ós rud é go n-athraíonn a gcumas ocsaídiúcháin cumhachtach iad in aigéid charbocsaileacha. Imoibrí Tollens, áfach, má stóráiltear é ar feadh i bhfad, cruthaíonn sé fulminate airgid (AgCNO) go spontáineach, salann airgid an-phléascach..
- Teitroxide Osmium(Béar4). In ainneoin chomh gann agus atá osmium, tá go leor feidhmchlár, úsáidí agus airíonna suimiúla ag an gcomhdhúil seo. I soladach, mar shampla, tá sé an-luaineach: casann sé ina ghás ag teocht an tseomra. In ainneoin gur oxidant cumhachtach é, le húsáidí iomadúla sa tsaotharlann mar chatalaíoch, ní imoibríonn sé le mórchuid na carbaihiodráití, ach tá sé an-nimhiúil i méideanna níos lú ná iad siúd atá inbhraite ag boladh an duine.
- Salainn aigéad perchloric (HClO4). Salainn perchlorate tá clóirín i riocht ard ocsaídiúcháin, rud a fhágann go bhfuil siad an-oiriúnach chun pléascáin a chomhtháthú, gairis piriteicniúla agus breoslaí roicéad, toisc gur ocsaíditheoir intuaslagtha go dona iad.
- Níotráití (UIMH3–). Cosúil le permanganates, is salainn iad ina bhfuil nítrigin i riocht ocsaídiúcháin suntasach. Bíonn na cineálacha comhdhúile seo le feiceáil go nádúrtha i ndianscaoileadh dramhaíola bitheolaíche mar úiré nó roinnt próitéiní nítrigineacha, a fhoirmíonn amóinia nó amóinia, agus a úsáidtear go forleathan i leasacháin. Is cuid riachtanach de phúdar dubh é freisin, ag baint úsáide as a chumhacht ocsaídiúcháin chun carbón agus sulfair a athrú agus fuinneamh calórach a scaoileadh..
- Sulfoxides. Faightear iad go príomha trí ocsaídiú orgánach sulfíde, úsáidtear an cineál comhdhúile seo i go leor drugaí cógaisíochta agus i láthair níos mó ocsaigine is féidir leo leanúint dá bpróiseas ocsaídiúcháin go dtí go dtiocfaidh siad chun bheith ina sulfóin, úsáideach mar antaibheathaigh.
- Trí-ocsaíd cróimiam (CrO3). Is solad é an comhdhúil seo de dhath dorcha dearg, intuaslagtha in uisce agus riachtanach i bpróisis chun miotail a ghalbhánú agus a chromadh. Déanann an t-aon teagmháil le eatánól nó le substaintí orgánacha eile adhaint láithreach ar an tsubstaint seo, atá an-chreimneach, tocsaineach agus carcanaigineach, chomh maith le bheith ina chuid thábhachtach de chróimiam heicavalent, comhdhúil an-díobhálach don chomhshaol.
- Comhdhúile le cerium VI. Is eilimint cheimiceach d’ord lanthanídí é cerium (Ce), miotal bog, liath, insínte, ocsaídithe go héasca. Úsáidtear na ocsaídí cerium éagsúla atá le fáil go forleathan go tionsclaíoch, go háirithe i ndéantús lasáin agus mar chloch níos éadroime ("tinder") trí chóimhiotal le iarann., ós rud é gur leor an frithchuimilt le dromchlaí eile chun spréacha agus teas inúsáidte a tháirgeadh.
Féadann sé freastal ort:
- Samplaí de Bhreoslaí sa Saol Laethúil